ibidi提供了一個簡單經濟高效的方案,使用可移除的12孔腔室載玻片進行細胞的培養,固定和染色。培養MCF-7細胞并用formalin溶液固定。細胞核用DAPI和肌動蛋白骨架用DYE-490鬼筆環肽染色。可以使用一抗和二抗染色通過免疫細胞化學探測其他細胞內結構。

德國ibidi 81201載玻片
實驗使用的材料和試劑列于下面。
12孔腔室載玻片,可移除(ibidi,81201)
用于腔室的蓋玻片,可移除,24mm x 60 mm(ibidi,10811)
細胞:MCF-7(CLS,300273)
細胞培養基
細胞培養試劑
聚苯硫醚
formalin溶液中性緩沖液,10%(Sigma,HT5011)
染色試劑
o DAPI(Sigma,D954)
o DYE-490鬼筆環肽(Dynomics,490-33)
安裝介質:FluoroshieldTm值(Sigma,F6182)

實驗方案:
步驟1:
必須在預實驗中確定細胞系的正確接種濃度。根據您的細胞類型,用2-6x10 4細胞/ ml在2-3天內產生匯合的單層。
1.打開12孔可移除腔室載玻片(ibidi,81201)包裝,在無菌條件下可拆除。
2.像往常一樣用胰蛋白酶消化并計數細胞。細胞濃度為5×104細胞/ ml MCF-7。
3. 將250μl細胞懸浮液加入腔室的每個孔中。避免搖晃,因為這會導致細胞分布不均勻。
4. 用配套的蓋子蓋住。在37°C和5%CO2下培養。細胞至少培養24小時,或直到建立融合的單層
步驟2:
固定是染色程序的第一步。目標是將細胞,細胞形成物或組織維持在其當前狀態,并在較長時間內通過化學試劑保存。
1.小心地吸出細胞培養基。
2.用PBS洗兩次。
3.加入250μl的formalin溶液。
4.在室溫下孵育30分鐘。
5.小心吸入formalin溶液。
6.用PBS洗滌三次。
步驟3:
應根據感興趣的細胞結構選擇染色試劑。在該方案中使用DAPI和DYE-490鬼筆環肽染色MCF-7細胞的細胞核和肌動蛋白骨架。
1.準備你的染色溶液:· 聚苯硫醚· DYE-490鬼筆環肽· DAPI 1µg/ml
2.小心吸出PBS。
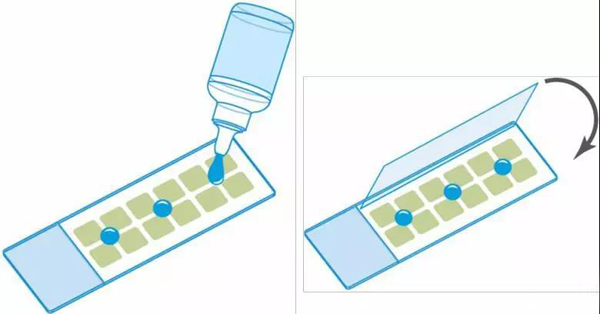
3.移取250μl染色溶液到每個孔中
4.在室溫下避光孵育30分鐘
步驟4:
在染色后清洗你的樣本會使背景信號降到很低
1.小心地吸出染色溶液
2.加入250μl緩沖液
3.小心吸入緩沖液
4.重復步驟2和步驟3一次
步驟5:
從一個邊部開始,用手或用鑷子小心地取下硅膠墊圈。該步驟應以緩慢,穩定的進行,以避免損壞細胞層。
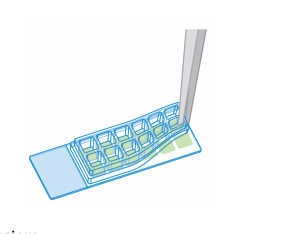
步驟6:
完成染色程序后,必須在用顯微鏡成像之前封固樣品。該步驟還防止樣品脫水。
1.將載玻片側面在干凈的實驗室濕巾上輕敲,從樣品中去除多余的介質。
2.將封固劑涂在樣品上。用24毫米x 60毫米的蓋玻片覆蓋安裝的樣品,小心地將蓋玻片放到安裝介質上,以避免夾住任何氣泡。推薦使用諸如FluoroshieldTm值(Sigma-Aldrich),Vectashield®(Vector Laboratories Inc.)或ProLongAntifade®(ThermoFisher Scientific)的硬化封固劑。
3.安裝封固劑固化。
步驟7:顯微觀察
使用12孔可移除載玻片培養MCF-7細胞,用DAPI和DYE 490鬼筆環肽染色細胞結構。使用硬化封固劑安裝載玻片保存樣品以便長期儲存。
圖1用DYE490鬼筆環肽(左上)染色MCF-7細胞的肌動蛋白骨架,并用DAPI(右上)染色細胞核。下圖顯示了合成圖像,其中細胞核為藍色,肌動蛋白骨骼為綠色。(比例尺:100μm)
